一、熱含量
- 定義:在定温定壓下,儲存於物質中的能量稱為熱含量或焓。
註:熱含量(焓)無法由實驗測得絕對值,只能推算出它的比較值。 - 特性
- 熱含量與温度、壓力、物質的種類及狀態(相)、量的多少有關。
- 單位:卡(cal)、千卡(kcal)、焦耳(J)或千焦(kJ)(1卡=4.18焦耳)
二、反應熱(∆H)
- 定義:化學反應中所產生的熱含量變化稱為:反應熱,也就是反應物與生成物熱含量之間的變化量,以∆H表示。
- 計算方法:
∆H=(生成物的熱含量總和)-(反應物的熱含量總和)
測量時,若在標準状態(25℃·1atm,溶液濃度為1M)下測出的反應熱稱為標準反應熱(∆Ho)。
註1:標準熱含量在標準状態(25℃·1atm)下,儲存於物質中的能量。
註2:元素的穩定形式,其熱含量為0。例如:碳是石墨、硫是斜方硫、磷是白磷。
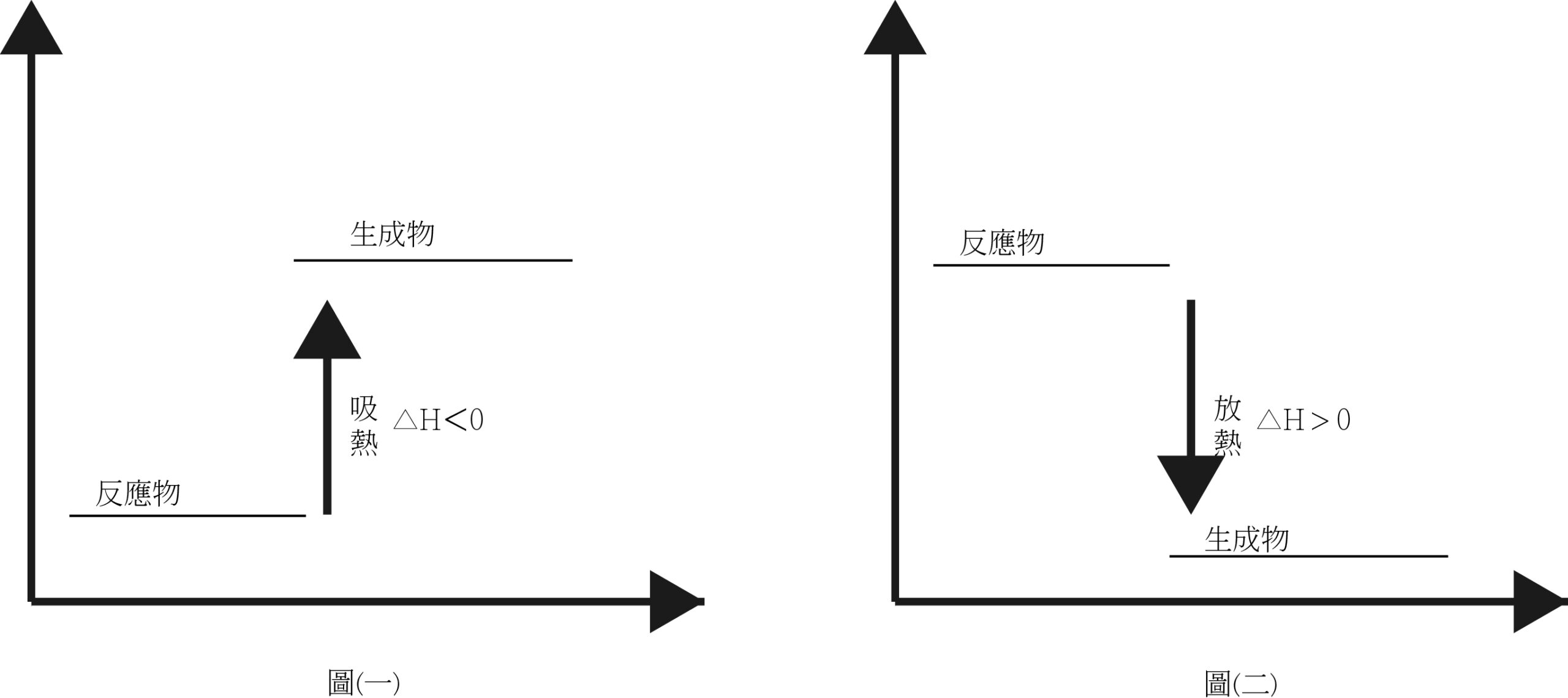
註3:同一分子其熱含量依狀態不同而不相同,氣體(g)>液體(l)>固體(s)。 - 反應熟(∆H)的二種狀況討論:
- 生成物的熱含量總和高於反應物的熟含量總和∆H>0,表示吸熱反應圖一。例如:電解、光合作用、醋酸鈉溶於水...等。
- 生成物的熱含量總和低於反應物的熱含量總和∆H<0,表示吸熱反應圖二。例如:燃燒、電池放電、酸鹼中和、氣體溶於水、強酸強鹼溶於水...等。
三、熱化學反應方程式
- 將反應物與生成物之物質狀態以及反應熱書寫於平衡的化學反應式之中。
常用的寫法有2種:
- 直接寫於化學反應式之中:
- 吸然反應:HgO(s)+90.7 KJ⭢Hg(l)+ 1/2 O2(g)
- 放熱反應:H2(g)+ 1/2 O2(g)⭢H2O+285.8KJ
- 獨立書寫於化學反應式之後:
- 吸然反應:HgO(s)⭢Hg(l)+ 1/2 O2(g) ∆H=90.7KJ
- 放熱反應:H2(g)+ 1/2 O2⭢H2O ∆H=-285.8KJ
四·反應熱基本定律
- 反應方程式逆寫·反應熱與原来等值異號。
H2(g)+1/2 O2(g)→H2O(g) ∆H1=-241.6kJ
H2O (g)→H2(g)+1/2O2(g) ∆H1=(-241.6*2)kJ - 反應熱和反應物的莫耳數成正比,故熱化學反應方程式×n倍,∆H值變為原来的n倍。
H2(g)+1/2 O2(g)→H2O (g) ∆H1=-241.6kJ
2H2(g)+O2(g)→2H2O (g) ∆H1=(-241.6*2)kJ
五、影響反應熱(∆H)之因素
- 反應物量之多寡:反應物的量愈多,反應熱就愈多。
H2(g)+1/2 O2(g)→H2O (g) ∆H1=-241.6kJ
H2(g)+1/2 O2(g)→H2O (g) ∆H1=(-241.6*2)kJ - 反應物或生成物之狀態:
H2(g)+1/2 O2(g)→H2O (g) ∆H1=-241.8kJ
H2(g)+ 1/2 O2(g)⭢H2O(l) ∆H=-285.8KJ


1 Comment
天氣熊
總結:
1、在定温定壓下,儲存於物質中的能量稱為熱含量或焓。無法由實驗測得絕對值,只能推算出它的比較值。
2、熱含量與温度、壓力、物質的種類及狀態(相)、量的多少有關。
3、化學反應中所產生的熱含量變化稱為:反應熱。
4、元素的穩定形式,其熱含量為0。例如:碳是石墨、硫是斜方硫、磷是白磷。
5、∆H>0,表示吸熱反應;∆H<0,表示吸熱反應。
6、方程式逆寫·反應熱與原来等值異號。反應熱和反應物的莫耳數成正比。
7、反應物或生成物之狀態:氣體>液體>固體。